Особливості змін параметрів голкової ЕМГ при патології нервово-м’язового апарату
автор: к.мед.н нейрофізіолог  Олексюк-Нехамес А.Г.
Олексюк-Нехамес А.Г.
Тлумачення поняття «денервації» необхідне для нейрофізіологічного тракування процесу проведення голкової ЕМГ.
У функціональному відношенні рухова одиниця являється лабільним елементом.
При патології нервово-м’язового апарату зміни в кожному окремому відділі системи приводять до перебудови структури рухової одиниці (РО). При тривалому існуванні м’язових волокон без контролю розвивається денерваційне порушення. У цьому випадку спрацьовує система захисту – компенсаторна іннервація збережених нервових елементів.
Компенсаторна іннервація м’язових волокон попереджує їх загибель
Компенсаторна іннервація забезпечується:
1.Здатністю мотонейрону до сприйняття сигналу денервованого м’язового волокна;
2.Здатність аксону до розгалуження;
3.Здатністю термінальних гілок знаходити денервоване м’язове волокно
4.Здатністю термінальних гілок утворювати новий синапс
Спраутинг здійснюється двома шляхами:
Колатеральний – розгалуження в області перехватів Ранвьє
Термінальний – розгалуження кінцевого аксону; Велику роль у індукції спраутингу грає порушення зворотнього захвату аксонального транспорту. Реіннервація іде не лише в денервованому мязі. Відмічається перебудова РО у симетричних м’язах. Таким чином кожен денерваційний процес супроводжується реінерваційними змінами. Цікаво, що у процесі перебудови рухової одиниці може змінюватися і її функція. Волокна І типу можуть перетворюватися на волокна ІІ типу, тобто знову іннероваване м’язове волокно може прийти у відповідність з іншими м’язовими волокнами, що переважають в даній РО
Поняття стадій денерваційно-реінерваційного процесу
Нормальною вважається така гістограма розприділення (ПРО) потенціалу рухової одиниці, при якій максимальна і мінімальна тривалість ПРО, що зареєстрована у конкретному м’язі не виходить за межі ± 30% від нормативного показника середньої тривалості ПРО
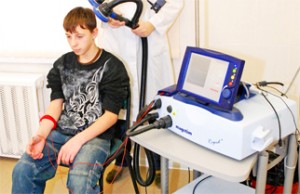
Приклад програмного вікна при проведенні голкової ЕМГ приладом НЕЙРОМИАН НМА-401
Проведення голкової ЕМГ при обстеженні м’язів язика у дитини при спадковій сенсомоторній невропатії (визначення денервації мязів язика)
У випадку загибелі м’язового волокна
У випадку загибелі м’язового волокна і зменшення розмірів РО гістограма розприділення ПРО по тривалості має тенденцію зсуву вліво, при збільшенні РО (зміні їх розміру) –зсув вправо. Приклад реєстрації ПДЄ і виділення необхідних для аналізу кривих
І стадія денерваційно-реінераційного процесу
Регіструється при міогенних процесах і при деяких первинно-мязових захворюваннях так і при хронічних нейрональних або невральних процесах (при відсутності масивного ураження); відповіді зміни і у хворих з міастенією; Гістограма розприділення РО (потенціалу рухової одиниці) по тривалості зсунута вліво за рахунок зменшення ПДЄ; Число поліфазних ПРО може наростати при міогенних процесах; Середня тривалість ПДЄ знижена на 13-20%
Прогресуюча мязева дистрофія (І стадія денерваційного процесу)
Аналіз ПДЕ при II стадії денерваційно-реіннерваційного процесу.
ІІ стадія денерваційно-реінерваційного процесу
Характеризує подальше поглиблення патологічних змін в м’язах при відсутності компенсаторної іннервації.При міопатіях, поліміозиті, і хронічних ураженнях периферичних нервів, що супроводжуються атрофією м’язової тканини. ІІ стадія виявляється при хронічних нейрональних ураженнях і міастенії. Спонтанна активність відсутня.Гістограма зсунута вліво Поліфазія збільшується при деяких міогенних процесах
Середня амплітуда ПРО зменшується відносно норми на 21%
Первинно-мязові ураження
1. спадкова первинно-мязова патологія (Спадкові невропатії, прогресуючі мязеві дистрофії, міопатії) Запальні ураження м’язів при системних захворюваннях (дерматоміозит, поліміозит, системна червона вовчанка)
Вторинні дисметаболічні ураження м’язів – міопатичні синдроми (паранеопластичні, ендотоксичні, ендокринні дисгормональні)
Спінальна аміотрофія Вердніга-Гофмана 2-тип 1 рік і 8 місяців.
епідеміологія
Група нейромязових захворювань – клінічно і генетично гетерогенна група спадково-дегенеративних захворювань , що характериується прогресуючою мязевою слабістю і атрофіями. За даними Мартинюка В.Ю. 2005 р. в Україні зареєстровано 1540 людей, які хворіють нейромявими захворюваннями. Щорічно виявляють біля 200 нових хворих, смертність досить висока.Відома класифікація нейромязових захворювань 1988 року ВОЗ, і сучасна адаптована клініко-молекулярна класифікація (1999 р.)
Особливості діагностики спадкових захворювань
Первинно-мязові процеси приводять до зменшення числа м’язових волокон в РО, що проявляється в значному зниженні амплітуди і тривалості ПДЄ іноді у збільшенні поліфазії.
Внаслідок мембранних порушень виникають потенціали фібриляцій і повільні гострі хвилі (патологічні феномени).
Особливості диференційної діагностики
Найбільша кількість повільних гострих хвиль буде виявлятися при швидкому процесі: а саме – прогресуюча м’язова дистрофія, поліміозит.
Одним зі складних моментів голкової ЕНМГ являється диференційний діагноз між прогресуючою мязевою дистрофією і поліміозитом.
Обидва захворювання мають клінічно подібну картину. При голковій ЕНМГ виявляють прогресуючу загибель м’язових волокон з невеликою кількістю потенціалів фібриляції і повільних гострих хвиль.
ІІІ а стадія денерваційного процесу що може характеризувати прогресуючі мязові дистофії (див. малюнок)
При прогресуючій м’язовій дистрофії
► Рухові одиниці втрачають мязеві волокна до яких ідуть найбільш довгі терміналі аксону.
В результаті такої перебудови в РО виникає ядро з мязевих волокон з короткими терміналями, синхронізованість скорочення яких наростає, що робить потенціал “гострим” і високим. (На голкових пробах ЕНМГ)
На периферії РО ступінь синхронізації скорочення мязевих волокон значно падає, що обумовлює появу поліфазії в початковій і кінцевій частині потенціалу.
Для прогресуючої мязевої дистрофії характерно виникнення великої кількості низькоамплітудних потенціалів фібриляції, які виникають в результаті денервації функціонально недіздатних мязевих волокон. Виникають позитивні гострі хвилі в результаті загибелі мязевих волокон. В гіпетрофованих мязах виникають псевдоміотонічні розряди у вигляді груп фібриляцій.
При міопатіях без прогресуючого протікання відмічається мала спонтанна активність з переважанням потенціалів фібриляцій. Позитивні гострі хвилі рідко виявляються. ПРО змінюються по міопатичному типу. Поряд з потенціалом зниженої амплітуди можуть виникати потенціали підвищеної амплітуди. Це характерно для тривало протікаючих міопатичних процесів.Підвищення амплітуди ПРО супроводжується поліфазією. Причиною збільшення амплітуди являється процес псевдогіпетрофії волокон.
1. Потенціали фібриляцій і 3. гігантські ПДЄ
При електроміографічній діагностиці хворих з міопатіями характерні зміни ПРО і вираженість спонтанної активності відображають характер і ступінь гостроти процесу, але не являються характеристикою клінічної форми міопатії. Клінічна форма встановлюється на основі комплексного (клінічного, біохімічного, медико-генетичного і нейрофізіологічного ) обстеження
При поліміозиті
(І інших запальних уражень мязів) за рахунок масивної загибелі мязевих волокон, що знаходяться на різній віддалі від аксону, збільшується десинхронізація скорочення. Амплітуда потенціалів на початковій стадії захворювання різко знижується. Ступінь зниження амплітуди ПРО перевищує ступінь їх вкорочення.Вони мають розтягнуту форму і стають поліфазні.
В результаті лікування глюкокортикоїдами при поліміозиті в першу чергу починає підвищуватися амплітуда, зменшуватися число і кількість позитивних гострих хвиль і потенціалів фібриляції. Підвищення амплідути потенціалу можна спостерігати уже після п’ятого прийому адекватної дози преднізолону (при прийомі через день).
При запальному ураженні м’язів гостроту процесу відображає масивність спонтанної активності, яка проявляється у вигляді позитивних гострих хвиль.
Вторинні дисметаболічні ураження мязів
Характеризуються різною ступінню перебудови РО. Зміни не протікають ізольовано, а супроводжуються різними невральними порушеннями . Тому частіше всього перебудова РО відповідає ІІІа або ІІІб-ЕМГ стадіям. Такі процеси не мають специфічного характеру а носять однотипний характер.
Гострота процесу визначається ступенем спонтанної активності, із якої частіше зустрічаються потенціали фібриляції.
Найбільші зміни виникають при паранеопласичних процесах.
Достатньо цікавим є момент перебудови РО при дисгормональних змінах , які спостерігаються у клімактеричному і у пубертантному періоді. В такому випадку перебудова РО не має певної скерованості. Спонтанна активність мінімальна, появляються одиничні потенціали фібриляції. Виникає “мигання” денервації і реінервації яке приводить до непостійності стадій що виявлені в одному мязі при повторних обстеженнях
Вторинні ураження м’язів
Вторинні ураження мязів наступають при ураженні мотонейронів і аксонів як результат денервації. В процесі компенсаторної реінервації сусідні непошкоджені аксони дають додаткові розгалуження до денервованим мязовим волокнам, що приводить до виникнення “гігантських” ПРО на фоні зниження їх кількості, наростає відсоток поліфазії
При вторинних аміотрофіях
Характер змін картини ПРО дозволяє віддиференціювати аксональне (невральне) ураження від нейронального. Обидва процеси приводять до денервації і морфофунціональній перебудові РО. За механізмом розвитку і клінічних проявів вторинні м’язові ураження можна поділити на: 1. наслідки гострих травматичних уражень, 2. хронічно протікаючих аксональних процесів і віддалених травм, 3.протікаючого нейронального захворювання. ЕМГ, в нормі дитина 14 років з метою порівняння (див. мал.)
Гостре травматичне ураження
Проявляється повним електричним мовчанням м язу протягом 11-21 дня (при повній перерізці нерву). На 11-21 день виникають потенціали фібриляції. При збільшенні терміну денервації амплітуда ПФ наростає, оскільки міняється обмін речовин у мязевому волокні. На 14-21 день виникають позитивні гострі хвилі. Відмічено, що спонтанна активність виникає тим пізніше , чим проксимальніше ураження.
При повному розриві нерва
Реінервація може відбуватися за рахунок росту коллатералів. Як правило, ознаки компенсаторної іннервації виникають не раніше 2-ох місяців після травми.
За цей час збільшується частота потенціалів фібриляції і стають гігінтськими ПРО
При неповному розриві нерва
Неповний розрив –це (Випадінні числа аксонів) – ступінь компенсаторної іннервації визначається ступенем ураження.
У зв’язку з тим що, мотонейрони приймають участь у компенсаторній іннервації, функційно повноцінні, вони в стані забезпечити ефективну реінервацію. Виникають гігантські ПРО, поліфазія.
Якщо відбулося масивне ураження аксонів, то здорові аксони по ходу компенсаторної іннервації перегружаються мязевими волокнами і не в стані забезпечити наступну їх іннервацію.
Таким чином настає загибель частини мязових волокон, що проявляється появою повільних гострих хвиль, наростанням їх амплітуди і тривалості , що вказує на декомпенсацію процесу реінервації.
Протікаючий демієлінізуючий процес
Приводить до збільшення асинхронності скорочення мязевих волокон. Потенціали стають не стілько поліфазними, скільки “псевдополіфазними”. Тривалість і амплітуда їх підвищуються. Спонтанна активність (а саме -потенціали фібриляції, повільні гострі хвилі) м’язових волокон відсутня.
Поява потенцалів фібриляції і повільних гострих хвиль вказує на охоплення патологічним процесом осьового циліндру аксону.
Фібриляції А) двохвазні Б)полі фазні В) дифазний; г) початково негативний ІІ. Част. (Мал. внизу) — позитивні гострі хвилі
Хронічне нейрональне ураження
Характеризується функціональною неповноцінністю і загибеллю мотонейронів.
У самому початку ураження виникає неспроможність мотонейронів, що приводить до протікаючої денервації. Виникають потенціали фібриляції і повільні гострі хвилі.
Особливості діагностики
Клінічно захворювання може проявлятися не відразу, тому схожі зміни при хворобі мотонейрону виявляються рідко (схожу денервацію можна спостерігати наприклад, при хронічних порушеннях нервово-мязової передачі, на ранніх стадіях невропатій). Подальше протікання захворювання приводить до загибелі великої кількості мотонейронів, але функціонально збережені мотонейрони ще можуть приймати участь у компенсаторній інервації. Виникають потенціали фібриляції, повільні гострі хвилі, потенціали фасцикуляції.
Потенціали рухових одиниць, що реєструються в здоровому м’язі (а) і при різних ураженнях рухового апарату (б-д). (мал.4)
Потенціали рухових одиниць, що реєструються при нейронопатіях на початковій (а, б) і на пізній (в, г) стадії хвороби.
При деяких видах полінеропатій можуть регіструватися великі потенціали з нормальним і збільшеним числом фаз, а также псевдополіфазні потенціали. Схожі зміни виявлені при хронічних прогресуючих полінейропатіях, при порфірії. Щільність мязевих волокон в руховій одиниці при полінейропатії змінена пропорційно ступеня выпадіння числа аксонов і величині компенсаторної іннервації. Ступінь збільшення щільності мязевих волокон пов’язаний не з характером процесу а з вираженістю перебудови Рухової Одиниці (РО). Діагностично важливо, що найбільш типовою електроміографічною ознакою ураження мотонейронів являється збільшення амплітуди і тривалості РО і поява великих, збільшених поліфазних і псевдополіфазних потенціалів (мал. 4). Це приводить до значного збільшення їх середньої тривалості у порівнянні з віковою нормою, при чому воно корелює з вираженістю аміотрофій. На ранніх стадіях протікання патологічного процессу в клінічно інтактних або незначно уражених мязах виявляють вузкі потенціали «міопатичного» типу.
Особливість нейронального ураження
Особливістю нейронального ураження, це рано виникнення гігантських ПРО, з одночасним виникненням великої кількості повільних гострих хвиль (ПГХ), потенціалів фібриляції (ПФ), і потенціалів фасцикуляції (ПФц) – паталогічні феномени
Гігантські ПРО (див. мал.вгорі )
Достовірність голкової ЕМГ
Достовірність отриманих результатів забезпечується детальним дотриманням методики проведення і вірним вибором тестованих м’язів. З більшого числа трьохсот мязів необхідно вибрати власне ті, у яких найадекватніше виникають патологічні зміни.
Розглянуті на малюнку невральний, переднє-роговий і первинно-мязовий тип ураження: мають в клініці загальні ознаки:
М’язову слабість і атрофію м’язів. Загальними ЕНМГ ознаками являється зниження амплітуди максимальної М-відповіді і числа функціональних Рухових одиниць (РО), ступінь якого може бути приблизно однаковий. Диференційно- діагностичними ознаками, що дозволяють відмежувати спінальні неавральні і мязеві ураження це зниження велини швидкості проведення і амплітуд неавральних Рухових одиниць: при первинно-мязовому патологічному процесі ці показники залишаються нормальними, при неавральному — зниження амплітуди неаврального Викликаного потенціалу (ВП) поєднується зі сповільненням швидкості проведення по нерву (за виключенням так званої аксональної форми полі невропатії, при якій швидкість проведення по нерву незначно знижується або нормальна), при переднє роговому спінальному уражені швидкість прведення по нерву залишається нормальна а амплітуд неавральних ВП різко наростає, досягає гігантської величини (передусім стосовно нервів верхніх кінцівок). Звичайно діагностична і диференційно-діагностична ефективність ЕНМГ показників зростає коли вони враховуються в поєднанні з результати клінічного дослідження, даними власне вивчення біоелектричної активності мязів в режимі спокою і мязевого скорочення, завдяки тільки голковій ЕМГ.
Методично варто розділити процеси ураження на групи:
1) локальні ураження м’язів, що обмежені зоною іннервації нерва;
2)Широко розповсюджені ураження з охопленням декількох груп м’язів (кінцівка, плечовий пояс, тазовий пояс);
3) дифузні генералізовані патологічні процеси
У випадку локального ураження
Досліджують саму уражену ділянку мязу, або мяз що знаходиться в зоні ураження і обовязково самий дальній від місця уражння (краще на протилежній стороні)
У випадку широко розповсюджених процесів
Можна додатково обстежити один проксимальний мяз на наближеній зоні до ураження гомолатеральної кінцівки;
У випадку дифузних процесів
Досліджують не менше чотирьох мязів на кінцівках, використовуючи наступний підхід: по одному проксимальному і одному дистальному мязу на протилежних кінцівках (рука-нога); В таких випадках із дистальних мязів обстежують найбільші: передній великий стегновий мяз, згиначі кисті і пальців;
Особливості вибору м’язів для обстеження
Небажано використовувати мяз, що відводить мізинець на руці, так як після 20-ти річного віку у результаті вертеброгенних процесів в ньому уже можуть виникати патологічні зміни.
З проксимальних м’язів обстежують дельподібний, двохголовий м’яз плеча і чотирьохголовий м’яз стегна (одно з головок м’язу)
Додаткові методи аналізу при голковій ЕМГ
Метод аналізу окремих Рухових одиниць РО достатньо точний в плані оцінки характеру ураження РО (рухової одиниці). Проте він складний і потребує високої спеціальної підготовки спеціаліста. На практиці буває стани коли в силу технічних біологічних чи суб’єктивних причин не вдається зареєструвати необхідне для аналізу кількість РО. Так наприклад при ураженні передніх рогів спинного мозку РО залишається так мало що зареєструвати 20 РО неможливо. Або в силу особистісних якостей пацієнта не вдається довести до кінця дослідження. Особливо це стосується дослідження дітей і осіб контакт з якими затруднений.
Тому по ходу розвитку голкової ЕМГ поряд з класичим дослідженням РО був запропонований метод аналізу інтерференційного паттерну при відведені голковими електродами. (Willison R.G. 1964) основною методою аналізу являється положення про те що при рекрутуванні додаткових РО при скороченні мязу наростає частота слідування РО рухової одиниці, які в подальшому накладаються один на одну. За рахунок сумації активності окремих РО наростає частота піків і амплітуда інтерференційного паттерну. Так як при голковій ЕМГ ми реєструємо відповідь з малої ділянки мязу, тому можна сказати з певною ступінню вірогідності що ми вивчаємо закономірності з рекрутованої ділянки мязу. На основі закономірності рекрутування РО Willison R.G. встановив взаємозв’язок частоти і середньої амплітуди кривої. Willison R.G. помітив, що при первинно-мязових ураженнях відмічається переважне наростаня частоти слідування кривої на фоні незначного збільшення амплідути, при нейрогених процесах переважно наростає амплітуда , тоді як частота знижується. В якості параметру частоти він використав не кількість пересічення ізоліній (фаз) , а кількість поворотів (турнів) піків отриманої кривої. Для виключення можливих артефактів вся крива по амплітуді роз приділяється на два потоки. Перший потік зафіксований в межах 100 мкВ (±50 мкВ відносно ізолінії) другий потік відмічається вище даного коридору. Власне другий потік проводить аналіз поворотів і змін амплітуди турнів для оцінки середньої амплітуди. Частота турна і середня амплітуда розрахована для епохи тривалістю 1 с. Проба проводиться з дозованою загрузкою. Доля біцепса використовувався груз – 2 кг, а для мязів ноги – 5 кг. Таким чином хворий з ураженими мязами мусить створювати постійне зусилля протягом 1 с., з введенням в уражений мяз голкового електроду. Записані декілька епох з різним положенням голки. Отримані розраховані дані відкладаються на скаттерограму у вигляді залежності середньої амплітуди від числа турнів в прямокутній системі координат з утворенням «хмарки» розприділенн крапок. Такий аналіз називається «турно-амплітудний» . На сьогодні цей метод модифікований Stalberg E. Antony L. 1981 запропонували різну ступінь загрузки для мязів при різному положенні голки. Для маленьких дітей Smith D.P.L. Willison R.G. 1982 запропонував метод коротких епох. В даному випадку він запропонував епоху не 1 с. а різні по 100 мс., отриманих в результаті одного скорочення. Даний підхід дозволив дослідити мяз при одному проколі шкіри при різній ступені напруження мязу. При цьому можна отримати більшу кількість точок, які підвищують точність обмалювання так званої «хмарки» аналізу. На сьогодні турно-амплітудний аналіз проводиться автоматично з використанням комп’ютерних алгоритмів. Автоматично іде побудова скаттерграм. На основі дослідження були запропоновані алгоритми автоматичного порівняння отриманих даних і нормативної хмарки, які були апробовані для скринінгового аналізу.
Такий метод має переваги перед класичною голковою ЕМГ: 1. він є швидким. Методика застосовується для аналізу практично любого мязу, де можна отримати електроміограму. 3. Даний метод можна застосовувати у дітей у віці до 3-5 років, коли контакт утрудений. 4. Метод добре відтворюється достатньо простий і не залежить від ступеня підготування міографі ста. Проте має і ряд недоліків: 1.Це метод переважно графічного аналізу візуального. Метод являється орієнтувальним і дозволяє диференціювати характер ураження тільки у випадку достатньої вираженості ураження. 3. У випадку ефективної реінервації в начальній стадії неаврального процесу методика дає помилкові результати. Метод дозволяє диференціювати нейро- генний і первинно-мязовий процес, але не дає можливості оцінити вираженість ураження, активність процесу, ступінь компенсації. Метод не працює у різко ослаблених мязах , тобто рівень активності в 100 мкВ може бути не досягнутий. Тобто метод можна застосовувати як додатковий при проведенні голкової ЕМГ.
 К.м.н. невролог нейрофізіолог Олексюк-Нехамес А.Г.
К.м.н. невролог нейрофізіолог Олексюк-Нехамес А.Г.