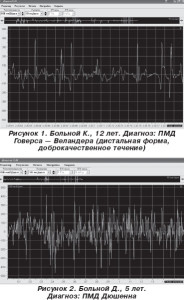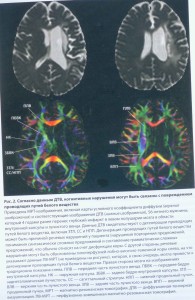
К.м.н Олексюк-Нехамес А.Г.
Венозна система мозку включається в патологічний процес первинно вторинно при порушенні кровообігу у артеріальній системі. В даній публікації розглядається поняття: венозна енцефалопатія, венозна дисфункція, тромбоз та інші). Для розуміння патогенезу різних порушень венозного кровопостачання важливо знати деякі закономірності будови венозного русла. До них варто віднести наявність венозних судинних зон.
На різних рівнях венозні зони повязані анастомозами що сприяють компенсаторному механізму і перерозприділенні венозної крові. Міжвенозні анавстомози характеризуються вираженою варіабельністю. Ці анастомози можуть бути внутрішньомозковими (між глибокими та поверхневими венами) і позамозковими ( в твердій мозковій оболонці, на основі черепу, в шкірних покривах голови).
При виникнені венозного застою в порожнині черепа індивідаульні особливості будови черепа і різних судинних зон мозку анастомозів можуть або погіршити або полегшити його протікання.
Великий інтерес складає для поясненя механізму венозного порушення взаємозвязок венозного та лікворного тиску.
•Відомо що всмокнтуваня ліквору відбувається через пахіонові грануляції у венозні синуси головного мозку через різницю тиску в субарахноїдальному просторі і твенозних синусах, де воно нижче 5-10 мм вод. Ст. резевним шляхом відтоку ліковору являється його всмоктуваня твердою мозквою оболонкою з переходом у венозу систему мозку.
•При підвищені внутрічерепного лікворного тиску або при утрудненні венозного відтоку число і розміри лакун можуть збільшуватися. Пульсація ліквору обумовлена венозною системою вт звязку з відкриттям заслонок субарахноїдальних вен при вдосі і видосі.
Міогенний механізм
•Міогенний механізм регуляції венозної гемоциркуляції представлений гладкими мязовими клітинами, що згруповані в місцях впадання вен в синуси, а також у верхніх та нижніх відділах внутрішньої яремної вени.
• В дрібних венулах вони заміщаються перицитами.
• Ці структури виконують роль шлюзів – що регулюють просвіт судин і здатні утримувати кров у венозному руслі.
• взаємозвязок
• Взаємозвязок процесів регуляції артеріального та венозного кровообігу видимий в умовах патології який може бути обумовлений недостатним притоком артеріальної крові до мозку, і затрудненям відтоку венозної крові від нього.
• Клінічні форми розладів венозної гемодинаміки:
• 1. венозний застій
• 2. венозна енцефалопатія
• 3.венозні крововиливи
• 4. тромбоз вен та венозних синусів
• 5. тромбофлебіти
• 6 утворення каротидно-кавернозних синусів.
• Короткочасне порушення венозного відтоку — при пчиханні кашлі, дефекації виникає у фізіологічних умовах.
• В умовах патології виникає венозна дистонія як порушення центральних регуляторних механізмів судинного тонусу, що веде до функціонально-динамічних розладів венозної гемоциркуляції.
• Клініка
• Первинно проявляютьсмя рефлекторною вазодилятацією (рідше вазоконстрикцією). Потім стійким вазопарезом що розвивається як наслідок ареактивності вазомоторного центру.
• При тривалому варіанті венозної дистонії порушення мікроциркуляції спотворюється робота клапанного апарату що проявляється гіперволемічним варіантом венозної гіпертонії.
• Формування венозної енцефалопатії
• Значно міняється мозковий метаболізм кисневий, вуглеводний і вдний баланс мозку, наростає гіпоксія гіперкапнія спирияє подальшому розвитку підвишенню венозного і внутрічерпного тиску і набряку мозку. – так формується венозна енцефалопатія.
• Фактори.
• Екстракраніальні фактори етіологічні формування поділяють на два види: повязані з патологією магістральних венозних мозкових шляхів та обумогвлені венозним засоем в малому колі кровообігу. Серед інших: травматична компресія грудної клітини, і живота, пухлини середостіння, шиї, остеохондроз шийного від.хв., вони приводять до компресії вен грудної клітки або венозних хребцевих сплетень.
• Синдроми порушення венозного кровообігу при патології серцево-судинної системи
• Клінічні синдроми поєднання патології магістральних судинних басейнів і периферійних неврогенних порушень.
• Корднеллі синдром.
• Корднеллі синдром.
• Порушення венозного кровопостачання уи верхній частині тулуба яка має різні причини (підвищення тиску в великих венах і в правому передсерді з прискоренням венозного тиску або ожиріння з відкладанням жиру в середостінні).
• Характерно венозний застій в верхній частині тулуба в положенні лежачи; розлади сну і дихання; нерідко портальний застій з асцитом, ішемічні поліневропатії кінцівок з вираженими шкірно-трофічними порушеннями.
• Синдром Айерси-
• Картина склероза системи легеневої аретерії. Присутній хронічний плямистий ціаноз, поліглобулінемія, гіперплазія кісткового мозку, пальці у вигляді барабанних паличок, задуха емфізема, хронічний бронхіт, вторині бронхоектази; також характерно гіпертрофія дилятація і недостатність правого серця з підвищенням венозного тиску.
• Рентгенологічно: розширені хілеси,легеневий рисунок тяжистий, розширена права частина серця, вигнута дуга легеневої частини серця. Серед неврологічних розладів переважають симптоми венозної інтракраніальної гіпертензії , епілептичний синдром, когнітивний дефіцит, поліневрпатія. Синдром Рейно, виражені егетативні розлади- субфібрилітет, дифузний гіпергідроз.
• Бенжета-Шретера-Кристрелі синдром
• Прояви порушення кровопостачання в підмишечній вені. На початку захворювання виникає поступове нерізке раптове припухання руки з почутям напруження характерна часта спонтання біль в руці, серця зрідка спостерігається ціаноз руки, переповнення, поверхневих вен, парестезія та слабість. В деяких випадках клінічні симптоми наступають після перегрузки руки. Вени плеча набухають. Нерідко приєднуються порушення трофіки шкіри і мускулатури, сегметраний гіпо- і гіпегідроз, гусина шкіра (гіперреактивність мязів, підмишечних волокон).
• Уражається переважно права рука ( у лівшів ліва). Протікання тривале з частими рецедивами. Хворіють переважно мужчини з розвинутою мускулатурою. Неврологічно визначається резистентна до лікування плексопатія з парезом проксимального відділу кінцівки.
• Симптом Вермеля-Маркелова
• Можлива ознака патологій судин головного мозку : звивисті розгалужені пепопвненні і напружені вискові артерії.
• Принуметала –Масумі синдром
• Це ангіоневротичний симптомокогмплекс у хворих що перенесли інфаркт міокарду болі в області серця та грудини яка триває часом без іррадіації характерно для стенокардії, слюнотеча та пітливість. ЕКГ як під час приступу так і після нього нормальна. Симптоми зникають після прийому анальгетиків, нітрогліцерин не дає ефекту.
• Прояви нейроревматизма
• Судинні форми:
• В дитячому і юнацькому віці при короткочасному захворюванні ревматизмом судинні форми ураження мозку спостерігаються рідко. Проте гемодинамісчні розлади з гіпоксією при тяжкому ураженні серця і декомпенсації можуть відмічатися у дітей.
• Крововитлив в мозок , при дитячих формах ревматизу, має венозний характер. Такий крововилив у дітей спостерігається при серцевій недостатності венозному застої і набряку мозку.
• Розвивається гостро раптово, з втратою свідомості і рвотою. Дитання затруднене по типу Чейн-Стоска. Обличчя ціанотичне, зіниці розширені, нерідко спостерігається анізокорія.
• Важкий загальний стан з вираженими загально мозковими симптомами часто може не дозволити виявити вогнищеву сипиоматику, стан швидко прогресує, наростає гіпоксемія і набряк мозку.
• Прогноз несприятливий – буває летальний кінець.
• Іншими частим судинними формаи ревматичного ураження нервової сиситеми є васкуліти з розвитком частквої або повної непрохідності. Клінічно він протікає як тромбоз.
• Причини асептичного внутрічерепного венозного тромбозу
• Важка дегідратація
• Захворювання серця (вроджені вади розвитку серця, серцева недостатність штучний водій ритму)
• Злоякісні новоутвори
• Вагітність
• Цукровий діабет
• Гормональні засоби(оральні контрацептиви, андрогени)
• Нефротичний синдром
• Причини асептичного внутрічерепного венозного тромбозу
• Політецимія
• Есенціальний тромбоз
• Коагулопатія( ДВС= синдром, гепатиноіндукована тромбоцитемія, антифосфоліпідний синдром, застосування антифібринолітичних засобів)
• Пароксизмальна нічна міоглобулінурія
• Захворювання сполучної тканини (васкуліти, СКВ, гранулематоз Вегенера, висковий артеріїт, хвороба Бехчета)
• Причини асептичного внутрічерепного венозного тромбозу
• Запальні захворювання кишківника (хвороба Крона, виразковий коліт)
• Цирроз печінки
• Черепно- мозкова травма
• пухлини
• Венозний тромбоз
• Венозний тромбоз – гостре захворювання, в основі якого лежить утворення тромбу в просвіті вени з елементами запалення (тромбофлебіт) і порушенням відтоку венозної крові.
За даними V. Wagemann (1973), гострий тромбоз глибоких вен, нижніх кінцівок і таза спостерігають у 1,87-3,13 % населення Швеції. У США венозний тромбоз є причиною госпіталізації 300 тис. хворих на рік, причому в 50 тис. хворих наступає летальний кінець від емболії легеневої артерії.
V. Schlosser (1977) відзначив розвиток гострого тромбозу глибоких вен після хірургічних операцій у 30 % хворих, травматологічних – 47 % і урологічних – у 34 %.
За даними Б.В. Петровського, гострий тромбоз глибоких магістральних вен таза спостерігають в 45,3 % померлих від гінекологічних операцій.
• Етіологія і патогенез.
Серед причин венозних тромбозів виділяють: інфекцію, травму, оперативні втручання, пологи, варикозно змінені вени, алергічні захворювання, інтравазальні уроджені й набуті фактори (перегородки, діафрагми, злуки, атрезії), екстравазальні уроджені й набуті фактори (компресія венозної стінки артеріальними стовбурами, аневризмами, пухлинами, медіастиніт).
• Особливими факторами ризику є онкологічні та ендокринні хвороби, похилий і старечий вік, операції на органах малого таза, ортопедотравматологічні операції, інтравазальні агресії (операції, інструментальні дослідження). Для розвитку венозного тромбозу необхідні три умови (тріада Вірхова): сповільнення кровообігу, пошкодження внутрішньої стінки вени та зміни згортальної системи крові – гіперкоагуляція.
• патогенез
• Більшість авторів вважають, що при будь-якій локалізації тромбозу в системі нижньої порожнистої вени вихідною точкою тромботичного процесу є вени, що дренують м’язи гомілки (глибокі вени гомілки). Існує думка про те, що в багатьох випадках тромбоз починається в тазових венах, а в подальшому процес має низхідний характер.
• Раціональним є також твердження про можливість біполярного тромбозу, коли процес одночасно починається у венах гомілки і таза. Важливим моментом у розумінні процесу тромбоутворення і механізму тромбемболічних ускладнень є так званий “флотуючий тромб”.
• Він утворюється при переході тромботичного процесу із вен меншого діаметра у вени більшого діаметра. Такий тромб не обтурує вену, не дає клінічної картини тромбозу венозного стовбура. Довжина його може досягати 15-20 см. Кровообіг по магістральній вені збережений. Проте в даній ситуації є висока ймовірність появи емболії легеневої артерії, що виникає як “грім з ясного неба” в результаті відриву тромбу, чи його фрагмента від стінки вени.
• Класифікація.
•
Тромбофлебіт поділяють на тромбофлебіт поверхневих та глибоких вен.
За локалізацією тромботичного процесу:
1. Поверхневі вени:
а) гомілковий сегмент;
б) гострий висхідний тромбофлебіт до середньої третини стегна та до устя великої підшкірної вени.
2. Глибокі вени – система нижньої порожнистої вени:
а) вени, які дренують м’язи гомілки (гострий тромбофлебіт глибоких вен гомілки);
б) підколінно-стегновий сегмент (гострий тромбофлебіт підколінної і стегнової вен);
в) ілеофеморальний сегмент (гострий тромбофлебіт здухвинної і стегнової вен, гострий ілеофеморальний тромбоз);
г) здухвинний сегмент (гострий тромбофлебіт здухвинних вен).
д) інфраренальний, ренальний і супраренальний сегменти нижньої порожнистої вени;
е) поєднаний варіант ураження кавоілеофеморального сегмента.
є) тотальний тромбоз усієї глибокої венозної системи нижньої кінцівки, наслідком якого є венозна гангрена кінцівки.
• За клінічним перебігам:
1. Гострий.
2. Підгострий.
3. Хронічний.
За стадіями тромботичного процесу:
1. Запалення (3-10 днів).
2. Організації тромбу (10 днів – 3-6 місяців).
3. Реканалюзація (3-6 місяців, розвивається посттромбофлебітична хвороба).
• Гострий тромбофлебіт поверхневих вен нижніх кінцівок.
Гострий тромбофлебіт поверхневих вен нижніх кінцівок може розвиватись на фоні варикозної хвороби, при випадках незмінених поверхневих венах чи проявлятись мігруючим тромбофлебітом. При наявності у хворого мігруючого тромбофлебіту поверхневих вен необхідно детальному обстежити пацієнта на предмет онкопатології, зокрема раку легень.
Клінічна картина гострого тромбофлебіту поверхневих вен залежить від локалізації тромбозу, розповсюдженості тромботичного процесу, ступеня втягнення в запальний процес навколишніх тканин та наявності ускладнень.
• Здебільшого гострий тромбофлебіт розвивається раптово, без видимої причини. Іноді йому передують травма варикозно розширеної вени, інфекційне захворювання, тривалий ліжковий режим. Хворих турбують біль у ділянці тромбованих вен, поява ознак запалення, загальна слабість, озноб, підвищення температури тіла, порушення функції кінцівки.
При огляді виявляють гіперемію шкіри, набряк тканин по ходу тромбованої вени, незначний набряк і пастозність у ділянці гомілковоступеневого суглоба та ступні.
Пальпаторно по ходу тромбованої вени визначають болючий тяж різного ступеня щільності, місцеве підвищення температури, гіперстезію шкірних покривів та паравазально болючі щільні інфільтрати різних розмірів, наявність вогнищ флуктуації свідчить про гнійно-септичне розплавлення тромбів.
• Загальне венозне повнокров’я — один з найчастіших типів загальних порушень кровообігу і є клініко-морфологічним проявом серцевої або серцево-легеневої недостатності.
• Патофізіологічна і патоморфологічна суть загального венозного повнокров’я полягає в перерозподілі об’єму крові в загальному колі кровообігу з накопичуванням її у венозній частині великого кола кровообігу (порожнистих венах, а інколи і в судинах легенях) і зменшенням в артеріальній частині.
• У механізмі розвитку (тобто в патогенезі) загального венозного повнокров’я відіграють роль наступні три основні чинники:
• 1. Порушення діяльності серця — серцева недостатність, причинами якої можуть бути:
• — набуті і природжені вади серця;
• — запальні захворювання серця (перикардити, міокардити, ендокардити);
• — кардіосклероз різної етіології (атеросклеротичний, постінфарктний);
• — інфаркт міокарда тощо.
• 2. Легеневі захворювання, які супроводжуються зменшенням об’єму судин малого кола кровообігу:
• — емфізема легень;
• — хронічна неспецифічна пневмонія;
• — пневмосклероз різної етіології;
• — пневмоконіози (пилові захворювання легень).
• 3. Пошкодження грудної клітки, плеври та діафрагми, що супроводжується порушенням присосуючої функції грудної клітки:
• — плеврити (в тому числі адгезивний);
• — пневмоторакс;
• — деформації грудної клітки і хребта.
Загальне венозне повнокров’я може бути за клінічним перебігом гострим та хронічним.
•Гостре загальне венозне повнокров’я є проявом синдрому гострої серцевої недостатності і гіпоксії (асфіксії). Причиною його можуть бути інфаркт міокарда; гострий міокардит; гострий ексудативний плеврит із зайвим накопичуванням плеврального випоту, який здавлює легені; високе стояння діафрагми (при перитоніті), обмежене дихання; тромбоемболія легеневої артерії; пневмоторакс; всі види асфіксії.
•Причиною венозного повнокров’я легень є лівошлуночкова серцева недостатність. Гостре венозне повнокров’я викликає розширення альвеолярних капілярів, що клінічно супроводжується транссудацією рідини в альвеоли (набряк легень). Також можуть виникнути внутрішньоальвеолярні крововиливи. На аутопсії з поверхні розрізу легень стікає у великій кількості рожево-червонувата, дрібно- і крупнопінява рідина.
•Правошлуночкова серцева недостатність викликає застій у великому колі кровообігу. При цьому в печінці спостерігаються розширення центральних печінкових вен і застій в синусоїдах у центральній частині печінкової часточки.
• Хронічне загальне венозне повнокров’я
• Хронічне загальне венозне повнокров’я розвивається при синдромі хронічної серцевої (серцево-судинної) або легенево-серцевої недостатності. Причинами його є вади серця, хронічна ішемічна хвороба, хронічний міокардит, кардіоміопатії, емфізема легень, пневмосклероз різного походження (циротичні форми туберкульозу легень, хронічна пневмонія, пневмоконіоз), скривлення хребта (горб або гібус в різних варіантах — сколіоз, кіфоз, лордоз), зрощення або облітерація плевральних порожнин спайками при злипливому плевриті.
Клініко-морфологічні прояви хронічного загального венозного повнокров’яПри зовнішньому огляді хворого, як з гострим, так і з хронічним загальним венозним повнокров’ям, звертає на себе увагу синюшне забарвлення шкіри (ціаноз), оскільки вени шкіри та підшкірної клітковини розширені і переповнені кров’ю. Через напівпрозорий шар епідермісу темно-червоний колір венозної крові має синюшний відтінок. У людини найбільший об’єм крові депонується у підшкірній клітковині і венах нижніх кінцівок. Шкіра, особливо нижніх кінцівок, стає холодною, синюшність або ціаноз добре помітні на обличчі в ділянці носа, вух, губів, а також на руках і ногах: в ділянці нігтьового ложа, кінчиків пальців. Синюшність виступаючих частин тіла називається акроціанозом.