К.м.н. Олексюк-Нехамес Алла Григорівна.
К.м.н. Олексюк-Нехамес Алла Григорівна.
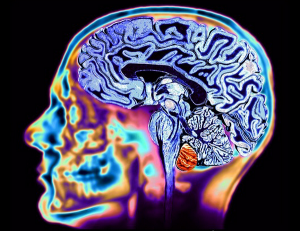
Класификація. Виділяють наступні хронічні і гострі варіанти порушення венозного кровообігу в мозку: До хронічних порушень відносять венозний застій і венозна енцефалопатія, до гострих: венозні крововиливи, тромбози вен і венозних пазух, тромбофлебіти. Класификація. Венозний застій. Венозний застій наибільш часта форма порушення венозного кровообігу обумовлений різними причинами: серцевою і серцево-легеневою недостатністю, захворюваннями органів дихання (бронхіт, бронхоектази, бронхіальна астма, емфізема і інші.); Інші причини венозного застою: Здавленням позачерепних вен (внутрішньою яремною, безимянною, верхньою порожнистою), струмою, аневризмою артерій, пухлинами в ділянці шиї; новоутворами головного мозку, оболонок і черепа, церебральним арахноїдитом, черепно-мозговою травмою, тромбозами вен і синусів твердої мозкової оболонки, здавленням вен при водянці мозку і краніостенозі. Патогенезу венозного застою. При венозному застої наступають зміни метаболізма і гіпоксія мозку, підвищується венозний і внутрішньочерепний тиск, розвивається набряк мозку. Частіше виникають більш легкі розлади у вигляді змін тонусу мозкових вен, що виявляеться з допомогою орбітальної плетизмографії і реографії. В звязку з підвищенням тиску при венозній енцефалопатії в яремних венах порушується відтік венозної крові із порожнини черепа. Хворі скаржаться на нічну, але особливо на ранню біль голови (погіршення відтоку венозної крові із черепа в положенні лежачи); часто при цьому має місце ціаноз і набряковість обличчя. Вдень і до вечора стан покарщується. Часті інші флебопатії — вен кінцівок, геморрой і інші. Зміни венозного кровообігу являються одними із важливих патогенетичних механізмів розвитку судинних захворювань головного мозку. Разом з тим, до останніх років, вивчення венозного компоненту мозкового кровообігу значно відставало по своєму обєму від досліджень артеріальної гемодинаміки. В останні роки появились наукові роботи, що свідчать про те що порушеннях мозкового крвообігу найважливіші патогенетичні фактори: недостатність притоку крові до тканин мозку в бассейні стенозованої або закупоренної артерії недостаточність або затримка венозного відтоку. Регіонарні зміни тонусу внутрічерепних вен приводять до венозного застою і порушенню мозгового кровообігу при вегетососудиній дистонії, атеросклеротичному ураженню судин мозку, артеріальній гіпертензії і гіпотензії, шийному остеохондрозі і інших станах. В формуванні внутрічерепного венозного застою приймають дистонія і гіпотонія вен мозку. Ці два процесси тісно взаємоповязані, так як при порушеннях кровопостачання в артеріях мозку в тій чи іншій ступені страждає венозний віттік; таким самим чином патологія вен мозку приводить до порушення артеріальної гемодинаміки і метаболізма мозку. На сучасному етапі венозну систему мозга розглядають як високоорганізовану рефлексогену зону, що відповідає за розвиток складних, компенсаторних реакцій, що мають важливе фізіологічне значення і забезпечують постійність мозкового кровотоку. Патогенез розвитку набряку мозку. Венозний застій в головному мозку являється найбільш частою формою розладів венозного мозкового кровообігу. При порушенні венозного застою наступають значні зміни мозкового метаболізму, нарушається кисневий, водний, вуглеводний, жировий баланс мозку, нарастає гіпоксія і гіперкапнія, підвищується венозний і внутрішньочерепний тиск , та як наслідок розвивається набряк мозку [1]. Класифікаційні форми венозної енцефалопатії згідно Т.С.Міщенко. Деякі автори виділяють наступні форми порушення венозного кровообігу: венозний застій, венозна енцефалопатія, венозні крововиливи, тромбози вен і венозних синусів, тромбофлебіти. (Е. 3.. Неймарк классифікує порушення венозного кровообігу мозку як ураження черепних венозних структур, порушення патології магістральних вен і порушення змішаного генезу, виділяючи в кожному випадку гострі, пігострі і хронічні форми.) До гострих форм і пігострих уражень черепних венозних структур відносяться венозні гематоми і геморрагії (підоболонкові, внутрішньомозкові), особливо при тромбозах синусів і внутрічерепних вен; флебіти, тромбофлебіти, флеботромбози синусів і вен різної, в том числі неясної етіології. Серед хронічних прогресуючих порушень мозкового кровообігу (дисциркуляторних енцефалопатій (ДЭ), окрім відомої енцефалопатії гіпертонічної і атеросклеротичної, деякі автори виділяють венозну енцефалопатію як одну із форм венозної патології мозку [6, 8]. М. И. Холоденко [8] відмічає наступні клінічні синдроми хронічної венозної недостатності (енцефалопатії): астеновегетативний, псевдопухлинний-гіпертензивний, поліморфний, беттолепсії, психопатологічний, інсультоподібний, синдром термінальних і претермінальних судом.У багатьох дослідженнях показана висока ступінь залежності ДЕ від венозного застою [3, 4, 9]. Це висуває проблему борьби з венозним застоєм хворих з ДЕ в число приорітетних. Недивлячись на значну розповсюдженість і значимість порушень венозного кровообігу в генезі розвитку ДЕ, ця патологія в широкій клінічній практиці часто не діагностується, а відповідно і не лікується. Клінічні прояви венозної енцефалопатії . Субфебрильна або іноді дуже висока стабільна або коливальна температура тіла, головна біль, рвота, лейкоцитоз в крові, підвищення внутрішньочерепного тиску. При тромбозі синусів конвексітальної поверхні мозку переважають загальномозкові симптоми, синусів основи мозку – ознаки ураження черепних нервів. Продовження клініки. Розвивається сонливість, іноді, навпаки, рухова активність , безсоння, бред, епілептичні припадки, ригідність шийних мязів, симптом Керніга, гіперестезія до зорових, слухових шкірних подразників, іноді тризм. Вогнищеві симптоми. Вогнищеві симптоми ураження головного мозку відповідають локалізації синуса. Відмічається набряковість , ціаноз обличчя або в ділянці соскоподібного отвору. На очному дні, визначаються розширені вени, набряк дисків зорових нервів. Картина ліквору. Цереброспінальна рідина прозора або ксантохромна, іноді з домішками еритроцитів; відмічається помірний плеоцитоз. Септичні тромбози синусів твердої мозгової оболонки проявляються ознобом, дуже високою ремітуючою температурою. При тромбозі верхнього сагітального синуса виникають епілептичні припадки моторного типа, гемі – і параплегії або парези. Симптоми тромбозу поперечного або сигмовидного синуса: головна біль, брадикардія, іноді двоїння в очах, септична температура, озноб, оглушенність, що переходить до сопорозного і навіть до коматозного стану, іноді бредовий стан та стан збудження, противобольова установка голови з нахилами в хворий бік, менінгеальні явища, лейкоцитоз в крові. В процесс може охоплюватися яремная вена. При цьому виникає набряк тканин, що оточують вену, та ознаки ураження язикоглоткового , блукаючого, додаткового і підязикового нервів. Симптоми тромбозу. Симптоми тромбоза кавернозного синуса: Екзофтальм, набряк і венозна гіперемія повік, орбіт, лоба, кореня носа, розширення вен очного дна (застійні явища), болі і гіперестезія в області іннервації верхньої гілки трійчастого нерва, хемоз конъюнктиви, офтальмоплегія – параліч або парез мязів, що иннервовані III, IV, VI черепними нервами, оглушенність, бред, іноді коматозний стан, порушення обміну і ендокринних функцій. Ускладнення: гнійний менінгіт, метастатичні абсцеси в легенях, септична пневмонія. Тромбофлебит вен мозга. При тромбофлебіті вен мозку підвищується температура до субфебрильних цифр з періодичними підйомами до 38–39 °С. Хворі скаржаться на болі голови, тошноту, рвоту. Спостерігається оглушенність, сопорозний стан, епілептичні припадки, парез кінцівок; на очному дні – набряк та розширення вен; в крові – лейкоцитоз; в цереброспінальній рідині – невеликий плеоцитоз, збільшення кількості білку і позитивні білкові реакції іногді суміш еритроцитів. Лікування порушень венозного кровообігу головного мозку: Скеровано на борьбу з запальним процессом, тромбоутворення і судинно-лікворною дисциркуляцією. При венозних крововиливах приміняють вікасол, препарати кальція, рутин, аскорбінову кислоту, вну утрішньовенне введення 5 мл 0,25–0,5 % розчину новокаїну і дегідратуючі засоби (фуросемід, маннітол, гліцерин). Зменшують застійні явища в венах завдяки засобам: глівенол (по 0,2 г 3–4 раза в день або 1 капсулі 0,4 г 2 раза в день протягом декількох тижнів), ескузан (15 крапель 3 рази в день). Призначення: ВЕНОСМІН, ТРОКСЕВАЗИН, СЕРМІОН, КАВІНТОН, ОКСИБРАЛ, ЛАТРЕН (ТРЕНТАЛ, ПЕНТОКСИФІЛЛІН, ЕУФІЛЛІН ) цитофлавін, мексиприм, армадин (емоксипін) (антиангінальні середники). Приміняють антикоагулянти (фенілін, синкумар, гепарин) при тромбозах і тромбофлебітах мозкових вен. Протипоказами являються ксантохромія в лікворі , септичний стан. Назначають ацетилсаліцилову кислоту, бутадіон. доцільно десенсибілізуючі середники (дімедрол, піпольфен). Трифлузал (дизгрен) антиагрегант на терапія, значно безпечніше ніж аспірин. препарат Флебодіа 600 мг (Иннотек, Франция), содержащий гранульований діосмин. Флебодіа 600 мг має венотонічний і ангіопротекторний вплив, зменшує явища венозного застою і порушення метаболізму завдяки нормализації мікроциркуляції. При наявності показів приміняють протисудомні середники (барбитурати, сібазон, кепра, депакін, топамакс, ламотриджин та інші), назначают анальгетики, серцеві, седативні препарати.
При гнійних процессах в поперековій і сигмовидній пазухах показане оперативное втручання.