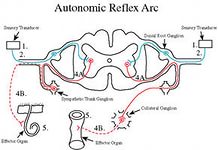
Порушення спінального кровообігу. Етіологія, патогенез, клініка,діагностика.
к.мед.н. невролог нейрофізіолог Олексюк-Нехамес А.Г.
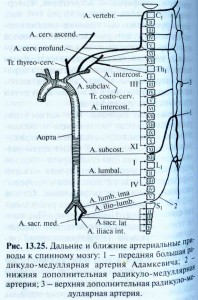
Клінічна практика підтверджує, що гострі судинні порушення спинного мозку зустрічаютьсмя доволі часто і викликаються численними етіологічними факторами (Скоромець А.А. 1995). Порушення спінального кровообігу можуть розвиватимя по ішемічному та геморагічному типу.Ішемічне вогнище локалізоване в зоні різних судинних басейнів, на їх рубежі в системі передньої та задньої спінальної артерії, можливе тотальне поперечне ураження спинного мозку на рівні критичних зон. Класифікація порушень спінального кровообігу. 1.Минущі порушення спінального кровообігу: а) синкопальний вертебральний синдром Унтерхарншейдта; б) синдром раптового падіння — дроп-атаки; в) мієлогенна переміжна кульгавість; г) каудогенна переміжна кульгавість. Гострі розлади спінального кровообігу: а) ішемічний спінальний інсульт; б) геморагічний спінальний інсульт — крововилив у речовину спинного мозку; в) крововилив під оболонки спинного мозку. Хронічні порушення спінального кровообігу: а) дисциркуляційна ішемічна мієлопатія. Патогенез. По довжині спинного мозку виділяють два артеріальні басейни:верхній — на рівні шийних та 1-Й верхніх грудних сегментів, який отримуєкров з хребетних артерій і гілок підключичних, і нижній — всі сегменти спинного мозку, розташовані нижче II грудного, який постачається кров’юсегментними гілками аорти. Сполучаючись, вони утворюють передню спі-нальну артерію Адамкевича, яка кровопостачає більшість грудних,поперекових і крижових сегментів. Іноді окремо формується нижня додаткова корінцево-спінальна артерія Депрож-Готерона, яка несе кров до конусу та епіко-нусу спинного мозку. Вени спинного мозку проходять паралельно артеріям, мають зв’язок з венозними сплетеннями, а через них — з венами порожнини тіла. Регуляція спінального кровообігу, як і мозкового, здійснюється за допомогою трьох механізмів: біогенного, метаболічного та неврогенного. За умови недостатності спінального кровообігу найвразливішими є ділянки суміжного кровопостачання, проте нерідко вражаються потовщення спинного мозку, які добре постачаються кров’ю. Безпосередньою причиною розвитку порушень спінального кровообігує тромбоз чи емболія однієї з корінцево-спінальних артерій на тлі слабкості серцевої діяльності, порушення серцевого ритму, розвитку синдрому обкрадання. Клініка. Розрізняють гострі та повільно прогресуючі (хронічні) порушення Вигляді імперативних покликів до сечовипускання або його затримки. Клінічна картина спінального інсульту поліморфна і залежить від локалізації та поширеності вогнища ішемії. Найчастіше інфаркт розвивається у зонах суміжного кровопостачання. Для шийного рівня характерна тетраплегія, розлади чутливості тапорушення функції тазових органів за центральним типом. Ураження грудного відділу спинного мозку проявляється центральним паралічем ніг, провідниковими розладами всіх видів чутливості татазовими порушеннями за центральним типом. Перехідні порушеня спінального кровопостачання. Це гостро виниклі симптоми порушення функцій спиного мозку у вигляді парапарезів або плегій з порушенням чутливості (або без них), розладами функцій тазових органів (або без них), які відновлюються протягом 24 год. Перехідні порушення спінального кровопостачання мають зворотній розвиток. Швидко відновлюються рухові функції. У багатьох хворих захворювання має ремітуюче протіканя. Провокуючими факторами є різкі рухи падіння інтеркуретні інфекції. І др. Як відомо грудний відділ знаходиться у гірших умовах кровопостачання , так як особливо вразливим є зони між басейнами радикуло-медулярних артерій на рівні DIV ; DVIII –X. Цей рівень ураження спинного мозку зустрічається найчастіше і відповідає вищезгаданим критичним зонам. Варто знати, що при перехідній мієлоішемії страждають як рухові нейрони передніх рогів спинного мозку , більш чутливі до ішемії. Так і рухові та чутливі шляхи в канатиках на рівні критичної зони, в поперечному плані – зона стика передньої задньої спінальних артерій. як варіант минущих порушень у верхньому спінальному басейні відомий як синдром раптового падіння — дропатак. (синдром «падаючої краплі») При різкому повороті голови в сторону або вираженому перерозгинанні у шийному відділі (відкидання голови назад) розвивається раптова м’язова слабкість і хворий падає. Напад триває від декількох секунд до 1-2 годин. Свідомості хворий не втрачає. Синдром виникає на тлі дегенеративно — дистрофічного ураження шийного відділу хребта (остеохондрозу) і зумовлений минущою ішемією сегментів шийного потовщення спинного мозку. Минущі порушення спінального кровообігу у нижньому артеріальному басейні, зокрема у руслі артерії Адамкевича, дістали назву мієлогенної переміжної кульгавості. Вона здебільшого виникає після фізичного навантаження, тривалої ходьби і клінічне проявляється слабкістю і онімінням ніг, іноді імперативними покликами до сечовипускання. Після нетривалого відпочинку (5-Ю хв) ці явища зникають. У випадку минущої ішемії у басейні артерії Депрож-Готерона виникає каудогенна переміжна кульгавість. Під час ходьби у хворих виникають болісні парестезії у вигляді поколювання, оніміння у дистальних відділах ніг та ділянці промежини. Якщо хворий продовжує йти і не відпочиває, з’являється слабкість ніг — синдром кінського хвоста. Причиною подібних розладів є остеохондроз поперекового відділу хребта або вроджене звуження хребетного каналу. Нерідко минущі порушення спінального кровообігу повторюються і є передвісниками розвитку стійкої ішемії спинного мозку. Ураження верхнього судинного басейну супроводжується розвитком синкопального вертебрального синдрому Унтерхарншейдта: у хворих із шийним остеохондрозом під час різких поворотів голови виникає напад з раптовою короткочасною (на 2-3 хв.) втратою свідомості. клініка. Спостерігається також значна слабкість у кінцівках, м’язова гіпотонія. Симптоми регресують через 3-5 хвилин. У проміжку між нападами хворі скаржаться на відчуття тяжкості, тупий біль та оніміння у ділянці шиї та рук. Напад є наслідком ішемії стовбурової частини головного та шийного потовщення спинного мозку. Дисгемію може викликати травма аорти або її гілок під час операцій нааорті чи на близько розташованих органах, а також виконання деякихмедичних маніпуляцій (епідуральної блокади, спинномозкової анестезії). Провокуючими чинниками бувають легка травма, фізичні перенапруження,різкі рухи, переохолодження тощо. Гострі розлади спінального кровообігу;а) ішемічний спінальний інсульт; б) геморагічний спінальний інсульт — крововилив у речовину спинного мозку; в) крововилив під оболонки спинного мозку. Хронічні порушення спінального кровообігу: а) дисциркуляційна ішемічна мієлопатія. Ішемічний спінальний інсульт. Гострі мієлоішемії появляються в результаті раптового або швидко прогресуючого порушення спинномозкового кровообігу в звязку зі здавленням закупоркою або ураженям спінальної судини з наступним розвитком розмягчення і утворення порожнини в зоні його васкуляризації. Інфаркт спинного мозку зустрічається в будь-якому віці – 51-60 років. До 40 років причиною інфаркту може бути васкуляти, хронічний перимедуллярний оболонковий процес, патологія аорти. Гострий ішемічний інфаркт нерідко розвивається на фоні симптомів перехідного порушення спінального кровопостачання або дисциркуляторної мієлоішемії. При локалізації вогнища на рівні поперекового потовщення виникає млява нижня параплегія з порушенням чутливості в ногах, розладами сечовипускання. Однак, незалежно від рівня, спінальний інфаркт супроводжується грубими трофічними розладами, швидким розвиткомипролежнів у ділянці крижів, сідниць, на спині та п’ятах. Від 40 до 60 років – спондилогенний процес. Інфаркт частіше розвивається гостро ніж підгостро або хронічно. Найбільш вразливім місцем є при гострому інфаркті являється нижня половина спинного мозку, при хронічних формах – шийний відділ. Остеохондроз хребта серед причин розвитку ішемічного інфаркта займає перше місце. Порушення функції тазових органів вимагає катетеризації сечового міхура, яка несе за собою інфікування сечового міхура та висхідний пієлоцистит. Пролежні та пієлоцистит є джерелом виникнення сепсису у таких хворих, що робитьпрогноз для одужання і життя сумнівним. За сприятливого перебігу захворювання та зменшення явищ ішемії неврологічні симптоми піддаються зворотному розвитку. Однак, у хворих спостерігаються стійкі залишкові явища у вигляді парезів та порушеннь чутливості. Етіологія. Серед причин порушення кровопостачання спинного мозку значне місце належить патології серцево-судинної системи вродженого (коарктація аорти, варикоз, артеріо-венозні та артеріальні аневризми, гіпоплазія спінальних судин) або набутого (атеросклероз, його поєднання з артеріальною гіпертензією, цукровий діабет, артеріїти, флебіти та інші запальні процеси в оболонках спинного мозку, хвороби серця) характеру. Частою причиною порушень спінального кровообігу можуть бути процеси, що впливають на судини ззовні: стиснення аорти та її гілок пухлинами вділянці грудної або черевної порожнини, компресія корінцево-спінальних артерій і корінцевих вен грижею дистрофічне зміненого міжхребцевого диска. Геморагічні порушення спінального кровообігу включають гематомієлію(крововилив у сіру речовину спинного мозку) та гематорахіс (крововиливпід оболонки спинного мозку). І.П. Антонов виділив три стадії захворювання: 1)спінальні болі: 2) загальномозкові та менінгеальні симптоми. Клінічна картина спінального субарахноїдального крововиливу. Клінічна картина спінального субарахноїдального крововиливу розвивається різноманітно. Ведучою ознакою являється інтенсивний больовий синдром, який починається раптово після провокуючого фактора та залежно від локалізації процесу може мати опоясуючий характер або проявлятися у вигляді стріляючої болі з ірадіацією в ногу. 3) вогнищеві спінальні симптоми. Ці стадії можуть проявлятися поступово іноді одночасно зі спізненям. Спінальний субарахноїдальний крововилив розвивається на фоні корінцевого синдрому або вогнищевого ураження спинного мозку після провокуючих факторів: (фізичне напруження різкі рухи, охолодження). На віміну від церебральних субарахноїдальні геморагії розвивадються серед симптомів благополуччя у практично здорових людей. Спінальний субарахноїдальний крововилив. Етіологія спінального субарахноїдального крововиливу різна , проте вона частіше викликана артеріовенозними аневризмами спинного мозку. Стадії захворювання. Через декілька годин можуть приєднатися загальномозкові симптоми: головна біль, тошнота, рвота, брадикардія, легка оглушеність, загальмованість. Менінгеальні симптоми мають свою особливість: ведучим симптом Керніга, в той час як ригідність мязів потилиці відступає на другий план. особливості: Симптом Керніга супроводжується больвим симптомом Ласега. Проте менінгеальні і загальномозкові симптоми при спінальному субарахноїдальному крововиливі розвиваються не зажди , в 1\3 випадків вони відсутні, що пояснюється спайковим процесом , що блокує субарахноїдальний простір або наявністю невеликої кількості крові, що вилилася з нижньої частини хребтового каналу.Диф. Діагноз з іншими захворюваннями.На відміну від мієліту гострому інфаркту спинного мозку може передувати корінцевий синдром або ознаки перехідного порушення спінального кровопостачання.При мієліті перед проявом спинномозкових симптомів появляються ознаки інфекційного процесу . В тому числі лихоманка, зміни крові запального характеру.Велике значення в діагностиці гострого інфаркту спинного мозку має значення дослідження ліквору. В перші 3- дня після інфаркту ліквор нормальний, 5-10 день, появляється відносна білково-клітинна дисоціація — велика кількість білку і невеликий цитоз, пов’язаний з некрозом мозкової тканини наявністю мікрогеморагій в зоні інфаркту. Цитоз відповідає формулі крові багато еритроцитів, менше нейтрофілів, ще менше лімфоцитів. Надалі через місяць форменні елементи крові розпадаються і в лікворі виявляється абсолютна білково-клітинна дисоціація.Неврологічні симптоми при мієліті будуть наростати повільно: спочатку спостерігається вяла параплегія, дисоційовані розлади чутдивості , немає ознак гострого поперечного ураження спинного мозку. При мієліті вірусної етіології як правило переважають лімфоцити. При некротичному мієліті збільшується кількість білку.Вияснення етіології факторів ішемічного інфаркта спинного мозку і мієліту має значення в уточненні діагнозу. Гострий мієліт зажди супроводжується більш чи менш високою температурою і запальними змінами крові, які виникають попередньо перед розвитком спінальних симптомів.При здавленнях особливо при внутріхребтових метастазах можуть виникати спинного мозкові симптоми і провлятися гостро. Це пояснюється вклиненням і здавленням спінальної судини і ішемія як наслідок. Радіоізотопна мієлометрія, — спінальний блок .ЯМРТ – судинний режим – спінальний блок.При ішемічному інфаркті лихоманка і зміни крові також можуть виникати, але не відразу а на 3-4 день, і повязані з урогенітальною інфекцією, запаленням легень інтоксикацією, що могла виниктури через розпад мозкового детриту.При розсіяному склерозі симптоми спінальні також розвиваються гостро. Проте в таких випадках захворювання супроводжується не вялими а спастичними паралічами, дисоційованими розладами чутливості. Загальний тяжкий стан , який буває при гострому інфаркті тут не спостерігається.Гостро вяла параплегія може розвинутися при синдромі Кліппеля-Тренон, що має аутосомно-домінантне успадщкування. Цей синдром характеризується гігантизмом окремих частин тіла з гіперплазією і дисплазією кровоносних судин: вроджена сегментарна шкірна ангіома( на нижніх кінцівках, рідше на верхніх) з раннього дитинства – варікозне розширеня вен нижніх кінцівок, нерідко артеріовенозні фістули, пігментні аномалії.В ураженій ділянці мягкі тканини гіпертрофовані, відмічається іхтеозоподібний дерматоз.Розлади спінального кровообігу при цьому синдромі зустрічаються в результаті закупорки судин спинного мозку, включаючи артерію Адамкевича або внаслідок розриву судинної мальформації. (Продовження з етапами лікувальної тактики буде викладено у наступних дописах) запитання та пропозиції: olekalla@gmail.com