Антифосфоліпідний синдром, етіологія, патогенез, діагностика
Автор: к.м.н. нейрофізіолог невролог Олексюк-Нехамес А.Г. (запис на консультацію 0677452596) Антифосфоліпідий синдром — АФС — симптомокомплекс що включає рецидивуючі венозні і артеріальні тромбози, різні форми акушерської патології, тромбоцитопенію, різні неврологічні серцево-судинні гематологічні порушення, серологічними маркерами яких є антитіла до фосфоліпідів (ФЛ) до кардіоліпіну, вовчаночний АГ(ВА), β-глікопротеїн-1-коферментозалежні антитіла.Етіологія, патогенез/ В основі розвитку АФС лежить утворення в організмі у високому титрі бімодальних антитіл, що взаємодіють з негативно зарядженими мембранними фосфоліпідами і пов’язаними з ними глікопротеїнами.Патогенез розвитку АФТФеномен біологічної неправдивої позитивної RW (Б-ЛПРВ) описаний при відсутності будь яких ознак сифілітичної інфекції і зустрічається в двох основних варіантах: — гострому і хронічному; В першому випадку у хворих з несифілітичною інфекцією зникає він з виздоровленням через 6 місяців. У другому може зберігатися протягом багатьох років при відсутності видимого причиного фактора.На початку 50-их років встановлено що хронічна Б-ЛПРВ часто є при СКВ 30- 44% далі знайдений волчаночний антикоагулянт – фактор який знаходять в плазмі хворих СКВ і інгібує згортання крові. Виявлено що цей фактор –імуноглобулін, вплив якого на комплекс “протромбін-тромбін” реалізується через взаємодію з фосфоліпідною порцією протромбін –активованого комплексу.Класифікація антифосфоліпідного синдрому1. Клінічні варіанти:Первиний АФСВторинний АФС:При ревматичних аутоімунних захворюванняхЗлоякісних новоутворах Застосуванні лікарських препаратів Другі варіанти: катастрофічний АФС;ряд мікроангіоатичних синдромів (тромботична тромбоцитопенія, гемолітико-уремічний синдром, ) синдром гіпотромбінемії;
2 серологічні варіанти: серопозтивний АФС з аКЛ\ або ВАСеронегативний; з IgM aФЛ реагуючими з фосфатидилхолыном;З АФС реагуючими з β-2-ГП -1 кофактор залежними аФЛ.
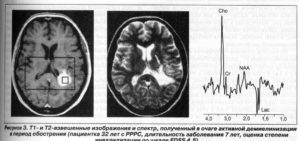
Головна особливість АФС являється висока ангіотропність і тромбогенність. В дебюті цього синдрому частіше домінують цереброваскулярні ураження – від зниження памяті , постійної болі голови, мігрені, перехідних порушень мозкого кровообігу і зору до тромбозів судин мозку, синусів, тромботичних інсультів, епілепсії і синдрому Снеддона, дебютними можуть бути і флеботромбози кінцівок ( з ТЕЛА і без неї) синдром Рейно
Моменти, на яких варто зупинитися при формуванні анамнезу хворого з АФС Спадковість Наявність у родичів: -ревматичних захворювань -Рецедивуючих інсультів (у віці до 50 років); -Рецедивуючих інфарктів (особливо у віці до 50 років) -Рецедивуючого тромбофлебіту -В анамнезі спонтанні аборти, еклапмсія, прееклампсія -Існує схильність до розвитку АФС інфекції У випадку якщо хворому раніше визначались аКЛ(антитіла до кардіоліпіну) а чи був зв’язок з виявленням антитіл з загостренням хронічної інфекції або з розвитком гострої інфекції. Поява антитіл до фосфоліпідів (аФЛ) при інфекціях часто не супроводжувалась утворенням тромбозів. Прийом лікарських засобів Гормональних контрацептивів Новокаінаміду Хінідину Гідралазину (входить в склад апрессину) Психотропних середників Прийом деяких середників може викликати волчаночний синдром (диф. Діаностика з червоним вовчком). або сдатністю до підвищення вироблення антитіл до фосфоліпідів. Клінічні прояви антифосфоліпідного синдрому з боку шкіри:— сітчате ліведо – це судинна сітка у вигляді синюватих плям на гомілках, стегнах, китицях, особливо добре видима при охолодженні;-тромбоз одної центральної вени;Геморагії і інфаркти;Поверхнева сип у вигляді точкових геморагій; що нагадує васкулітНекроз шкіри дистальних відділів кінцівок;Хронічні виразки кінцівок Крововиливив піднегтеві ложа; Шкірні вузлики; Підошвова і долонна еритема; Великі судини- синдром верхньої порожнистої вени – різке почервоніння обличчя взування судинСиндром нижньої порожнистої вениСиндром дуги аорти- різко підвищення АТ на руках і ногах, велика різниця мінімального АТ на руках і ногах, шум на аорті. Кістки: Асептичний некроз Транзиторний остопороз у відсутності прийому глюкокортикоїді. Нирки:Тромбоз ниркової артеріїІнфаркт ниркиВнутріклубочковий тромбоз (ниркова тромботична мікроангіопатія) з розвитком гломерулосклерозу і хронічної печінкової недостатності : очі Тромбоз вен сітківки Тромбоз артерій і артеріол сітківки Атрофія зорового нерва Інфаркти сітківки Дрібні ексудати які виникають внаслідок оклюзії артеріол сітківки наднирники. Тромбоз центральної вени. Геморрагії і інфаркти.Наднирникова недостатність. Хвороба Аддісона (якщо хворий дістає глюкокортикостероїди діагностика наднирників досить утруднена. Акушерська патологія.Звикле невиношування вагітності – спонтанні аборти ( наявність 2 і більше спонтанних абортів) Внутрішньоутробна загибель плоду Гестоз, особливо важкі його прояви прееклампсія і еклампсія — хорея вагітних Затримка внутріутробного розвитку плоду Передчасні пологи;
Лабораторні критерії при АФС антитіла до кардіоліпіну Ig G IgM сироватці середніх і високих титрах виявляють в 2 рази протягом 6 тижнів при визначенні з допомогою стандартизованого імунноферментного методу, що дозволяє визначити залежні від β-2-глікопротеїну антитіла. Лабораторні критерії при АФС ВА (волчаночний антикоагулянт) що виявляють в плазмі 2 рази протягом 6 місяців стандартизованим методом, включаючи наступні етапи: видовження залежного від фосфоліпідів згортання крові при застосуванні скринінгового тесту (активоване часткове тромбопластиновий час, каоліновий тест)
Для постановки достовірного діагнозу АФС необхідно 1 клінічний і 1 лабораторний критерій.
Профілактика і лікування АФС Профілактика і лікування тромбозів при АФС – не менш складно, ніж його коректна діагностика. Це пов’язано з неоднорідністю патогенетичних механізмів, що лежить в основі АФС, Поліморфізмом клінічних проявів відсутністю достовірних клінічних і лабораторних показників. Рекомендації по профілактиці і лікуванню тромбозів у хворих з АФС/ Для АФС характерно високий ризик рецедивування тромбозів, велике число хворих потребує проведення профілактичної антикоагулянтної терапії протягом тривалого часу, іноді пожиттєво. Виключення складають хворі зі стійкою (протягом декількох років) нормалізацією рівня аФЛ (антитіл до фосфоліпідів) у відсутність рецедивів тромбозів. Проте і в такому випадку ризик рецидивування тромбозів не можна повністю виключити і хворі потребують постійне динамічне спостереження і вірогідно низьких доз аспірину. Збільшення рівня аФЛ у відсутність клінічних ознак
Одним з суперечливих питань залишається питання про доцільність профілактичного лікування хворих з позитивними результатами аФЛ, але без клінічних ознак АФС. Достовірних прогностичних факторів ризику (або рецедивування) тромбозів і акушерської патології не встановлені. Виділяють окремі фактори ризику при розробці таких хворих. За думкою більшості різних дослідників у осіб з високим рівнем аФЛ у сироватці крові, але без клінічних ознак АФС (у вагітних без акушерської патології в анамезі) можна обмежитися назначенням низьких доз аспірину. Проте певний ризик розвитку тромботичних ускладнень обумовлює необхідність динаміче спостереження таких хворих. Додатковий профілактичний момент можуть мати амінохінолові препарати (гідроксихлорохін) . Фактори ризику тромбозу при АФС. Відомо що поряд з протизапальним ефектом гідроксихлорохин дає певний антитромботичний і (подавляє адгезію і агрегацію тромбоцитів, зменшує розмір тромба) гіполіпідемічний еффект.Проте хоча застосування гідроксихлорохіна дозволяє знизити частоту тромботичних ускладнень, невідомо наскільки доцільно використання цього препарату у людей з високим вмістом аФЛ при відсутності інших захворювань. Рекомендації по лікуванні жінок з АФС. Група 1 З АФС але без неплацентарних тромбозів (наприклад тромбоз глибоких вен в анамнезі) Група 2 З аФЛ і невиясненими спонтанними абортами (до 10 тижнів гестації) в анамнезі (два і більше) Група 3. з АФС з неплацентарними тромбозами в анамнезі (часто застосовує варфарин). Група 4. тільки аФЛ без попередньої вагітності з одним епізодом невиясненного спонтанного аборта до 10 тижнів гестації без тромбозів в анамнезі Аспірин (81 мг\добу) з моменту зачаття+нефракційний гепарин (10 000 Од кожні 12 год. З моменту документованої вагітності (через 7 тижнів піл гестації) до моменту пологів. Відновити лікування гепарином (або варфарином) через 12 год після пологів протягом 6 тижнів. Окрім нефракційного гепарину можна використати низькомолекулярний гепарин (єноксіпарин по 1 мг\кг або дальгепарин 50 од на 1 кг один раз в день) з наступним підбором дози в кожному триместрі. При збереженому ризику передчасних пологів замінити низькомолекулярний гепарин нефракційним гепарином як можна раніше (до 6 тижнів гестації) відмінити варфарин і назначити нефракційний гепарин з низькими дозами аспірину.Зауваження: Всім хворим що приймають гепарин варто приймати препарати кальцію (1500 мг\добу) і вітамін D (800 МЕ\добу) для профілактики остеопорозу;При неефективності стандартної терапії в період наступної вагітності доцільно довенно введення імуноглобуліна (по 0,4 г\кг протягом 5 днів кожного місяця вагітності).Тактика лікування варфарином при АФС така сама як і при інших тромбофлібітах – початкова доза 5-10 мг\добу протягом перших 2 днів, а далі з врахуванням МНО підбір оптимальної дози . Назначення такої дози рекомендоване оскільки рідко приводить до надлишковій антикоагуляції (збільшення МНО >3) і транзиторній гіперкоагуляції, остання виникає через зниження білку С протягом перших 36 год. Лікування варфарином.
Лікування варфарином дозволяє надійно попредити рецедиви венозних тромбозів, проте деяким хворим з артеріальними тромбозами воно недостатньо ефективно.
В таких випадках рекомендовано комбінована терапія непрямими антикоагулянтами і низькими дозами аспірину (або дипирадамолу) , яка найбільш виправдана у осіб молодого віку без факторів ризику кровотеч (вторинний АФС, порушення функції тромбоцитів пов’язане з наявністю ВА дефекти протромбіну).Варто обов’язково відмітити, що припинення прийому непрямих антикоагулянтів , як правило приводить до рецедиву тромбозів (іноді до розвитку катастрофічного АФС) причому ризик повторних тромбозів високий в перші 6 місяців після відміни антикоагулянтів.Прийом непрямих антикоагулянтів пов’язаний з можливим ризиком розвитку кровотеч, особливо при МНО >4 і у хворих з такими факторами ризику кровоточивості як похилий вік , неконтрольована артеріальна гіпертензія (систолічний тиск >180 мм рт ст, діастолічний > 100 мм рт ст), виразкова хвороба шлунка, прийом акоголю, прийом нестероїдних протизапальних середників.Центральне місце в лікуванні гострих тромботичних ускладнень при АФС займає прямий антикоагулянт – гепарин і особливо препарати низькомолекулярного гепарину.
Якщо хворий до того не отримував непрямих антикоагулянтів, то їх варто назначати протягом перших 24-48 год. Від початку гепаринотерапії. Лікування гепарином варто застосувати у хворих до моменту досягнення МНО в межах 2-3.
У хворих з ризиком розвитку рецедивування тромбозів протягом тривалого часу повинна проводитися профілактика з використанням низькомолекулярного гепарину.
Для лікування катастрофічного АФС використовується весь арсенал методів інтенсивної і протизапальної терапії , що застосовується для лікування критичних станів при ревматичних хворобах. Ефективність терапії залежить від можливості усунути фактори, що провокують її розвиток.
Розвиток цього синдрому (АФС) фактично являється єдиним абсолютним показом до проведення сеансів плазмофорезу у хворих з АФС , який варто поєднувати з максимально інтенсивною антикоагулянтною терапією.
Варто відмітити суттєві переваги низькомолекулярного гепарину , які майже витіснили нефракційний гепарин при лікуванні венозних тромбозів і акушерській патології у жінок з АФС. Лікування аспірином і гепарином дозволяє знизити ризик розвитку венозних і артеріальних тромбозів, які нерідко розвиваються у хворих з АФС на фоні вагітності. Використання непрямих антикоагулянтів протипоказано.
Гематологічні ускладнення. Помірна тромбоцитопенія нерідко спостерігається у хворих з АФС , не вимагає спеціального лікування. При вторинному АФС рамках СКВ тромбоцитопенія добре компенсується ГК амінохіноловими препаратами а в резистентних випадках низькими дозами аспірину. Тактика лікування резистентно важкої тромбоцитопенії (менше 50-10 9\л) що створює загрозу кровотеч не розроблена до кінця. Цим хворим наряду з застосуванням ГМ у високих дозах доцільне введення імуноглобуліну.