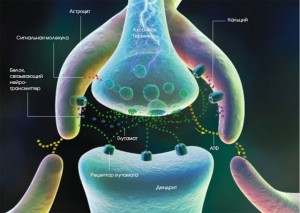
Радикулопатії, діагностика екстравертебральних синдромів, (особливості будови зв’язок)(дегенеративно дистрофічні ураження хребта та неврологічні ускладнення у вигляді ураження периферійної нервової системи). Автор : к.мед.н. Олексюк-Нехамес Алла Григорівна (запис на консультацію 0677452596) На сучасному етапі прийнято вважати , що дегенеративно–дистрофічні хворювання хребта – найбільш розповсюджені хронічні захворювання , що харектеризуються прогресуючим дегенеративно–дистрофічними змінами тканин хребтових сегментів –деградацією тканин міжхребцевих дисків , суглобів, звязкового апарата, кісткової тканини хребта , в гірших хронічних і запущених випадках проявляється важкими ортопедичним , неврологічними і вісцеральними порушеннями нерідко приводять до втрати працездатності . Особливості будови звязкового апарату хребта.Знання особливості анатомії руху хребта забезпечують розуміння його біомеханіки Всі хребці сполучені між собою при допомозі не лише хрящів але і суглобів зв’язок та м’язів, які можуть бути зміненими в бік розслаблення та гіпертрофії. Тіла хребців (крім атланта і осьового) сполучаються міжхребцевими дисками. Анатомічний комплекс що складається із двох хребців і одного м\х диску, двох відповідних дуговідросткових суглобів та зв’язок, що розміщені на даному рівні – представляє собою – руховий сегмент. Кіфоз. Поперековий відділ хребта в розрізі, будова зв’язкового апарату, задня поздовжня зв’язка, жовті зв’язки, Кожний міжхребцевий диск складається із периферичної частини – фіброзного кільця і центральної частини – студенистоподібного ядра. В атлантопотиличному та атлантоосьовому суглобах міжхребцеві диски відсутні. Атлантопотиличний суглоб складається з двох мищелкових суглобів еліпсовидної форми. Рухи в ньому – фронтально і сагітально. Атлантоосьовий суглоб складається із чотирьох суглобів – двох парних — бокових і двох середніх – переднього і заднього. В даному суглобі іде обертальний рух. Позаду зуба осьового хребця натягнуті дуже міцні та потужні зв’язки, які запобігають травматизації спинного мозку. Передня продольна зв’язка – охоплює передньобокові поверхні тіл хребців, і дещо щільно сполучена з диском і стисло з тілами хребців біля місця їх з’єднання з крайовими каймами. Ця зв’язка натягнута слабше, вона менше – не достатньо міцна, ніж звязки в грудному та поперековому відділі. Задня продольна зв’язка іде по задній поверхні тіл хребців і дисків в порожнині хребтового каналу. Вона сполучена з тілами хребців нещільною клітковиною, в якій закладене венозне сплетення, що приймає вени із тіл хребців. Жовті зв’язки та їх роль для руху в хребті.Між поперечні зв’язки парні, сполучають верхівки поперечних відростків. Крім фіброзних волокон у вказаних зв’язках є еластичні жовті зв’язки, які разом з дисками забезпечують еластичність хребтового стовпа. Жовті звязки сполучають дужки хребців і суглобові віростки. В силу своєї еластичності — ці зв’язки наближають хребці, і протидіють зворотньо направленій силі студенистоподібного ядра, намагаючись збільшити віддаль між хребцями.Роль жовтої зв’язки Жовтої зв’язки не має між дугами атланта і епістрофея а утвори між цими дугами називаються атлантоепістрофеальною мембраною. Між цією мембраною і задньою поверхнею суглобового відростка залишається простір що пропу скає другий шийний нерв.Між остистими та поперечними відростками і між дугами хребців натягнуті короткі але еластичні . Має значення: Васкуляризація спинного мозку, розташування задньої серединної артерії, передньої спінальної артерії, задньої корінцевої артерії, вентральна бокова артерія, вентральна корінцева артерія. Слабкі точки фіброзного кільця: задньо-серединна слабка точка. Задне-латеральна слабка точка. Інші можливі причини больового синдрому в поперековому відділі хребта при ішиалгі Защемлення одно чи багатьох корінців спинномозкових нервів може бути наслідком не лише зміненого диска але і спондильозних кісткових виростів з різним ступенем стеноза бокових пазух і міжхребцевого канала, з гіпотрофією апофізіальних суглобових поверхонь або з причини виникнення спінального арахноїдиту.Інші причини больового синдрому:Артрит. Остеоартрит (зокрема, множинна спондилітна каудальна радикулопатія представляє собою другий варіант гіпертрофічного артрита, як і вроджене звуження каналу поперекового відділу хребта, на рівні LIV- LV приводить до індивідуальної схильності або до розриву м\ж д.або до артрозу..Анкілозуючий спондилоартрит — артрит (Марі-Штрюмпеля)Ревматоїдний артритХвороба Педжета.Інші деструктивні захворювання: пухлинні, інфекційні і метаболічні. (соматичні)Одна із причин болю – злами та травми тіла хребця. Гострі болі в спині різної етіології та інтенсивоності спостерігаються у 80–100% населення. Біля 40% хворих звертаються за медичною допомогою . Відомо, що після 30 років кожна пята людина в світі страждає дискогенним радикулітом, що являється одним із синдромів дегенеративно–дистрофічних захворювань хребта.Серед структурних змін хребта що викликають болі в спині , можна виділити наступні :грижі пульпозного ядра;Вузький хребтовий канал (звуження хребтового каналу);нестабільність внаслідок дискової або екстрадискової патології;мязево–тонічний або міофасціальний синдром. Проведенні дослідження встановили , що 80% часу хребет перебуває у вимушеному положені (півзігнутому). Тривале перебування в такому положенні положении викликає розтягнення мязів згиначів спини і зниження їх тонуса.Вертеброгенні причини дорсалгій [Вознесенская Т.Г., 2004 г.]: – це дегенеративно–дистрофічні захворювання хребта та їх прояви – грижи (кили) дисків, деформуючий спондильоз, сподилоартроз. В більшій ступені з больовим синдромом ассоційовані захворювання , не повязані з з дегенеративно – дистрофічними захворюваннями хребта: сакралізація, люмбалізація, анкілозуючий спондиліт, остеопороз, хвороба Бехтерева.Це один із основних факторів які приводять до виниркнення дегенеративно- дистрофічних захворювань хребта. (часткова лекція по вертеброгенній патології)
Октябрь 2025 Пн Вт Ср Чт Пт Сб Вс « Янв 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 Метки
"функціональні системи" writer's block Арахноїдит БАС ВССП ГПСК ЕНМГ ЕНМГ ВССП КІНОЛЕВ Лірика Олексюк-Нехамес А.Г. РСД ССВП акупунктура аномалії судин вегетологія викликані потенціали головного мозку голкова ЕМГ гіпертензійний синдром деменція депресія депресія у дітей діти ВССП електронейроміографія когнітивні порушення викликані потенціали координати Олексюк кінезітерапія лекції по електрогенезу м магнітотерапія міографія нейрофізіологія нові події особливості методу ЕНМГ остеохондроз покази до проведення ЕНМГ права на сайт пізні феномени нейрофізіологія радикулопатії рефлексотерапия спадкові хвороби спінальні інсульти сум з приводу Кінолеву топічна діагностика цереброваскулярна патологія